Imaginez un monde sans batteries, sans écrans, sans électrolyse. Difficile, n'est-ce pas ? Au cœur de ces technologies se cachent deux acteurs essentiels : la cathode et l'anode. Ces deux électrodes, à la fois opposées et complémentaires, sont les piliers de nombreux processus électrochimiques qui façonnent notre quotidien. Ce voyage au cœur de l'électrochimie vous permettra de décrypter les secrets de ces deux pôles électriques.
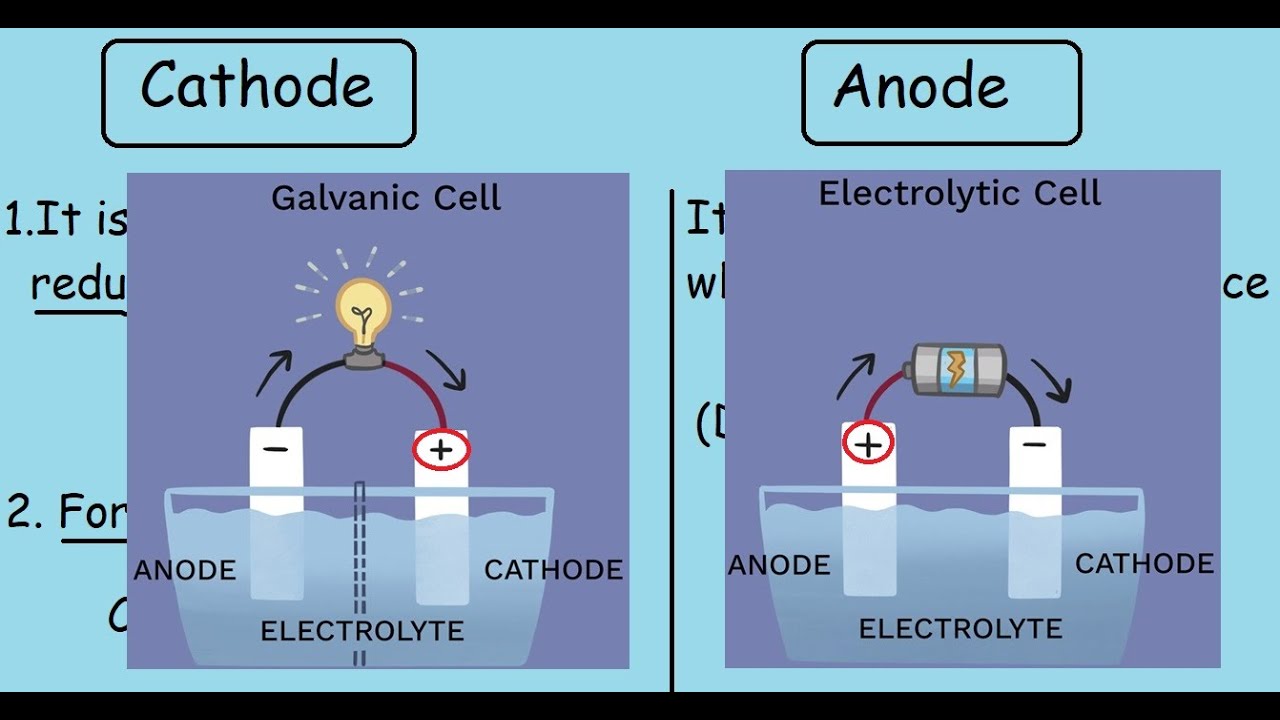
Pour comprendre le rôle de la cathode et de l'anode, il faut plonger dans l'univers des charges électriques. L'anode est l'électrode où se produit l'oxydation, c'est-à-dire la perte d'électrons. A l'inverse, la cathode est le siège de la réduction, où les électrons sont gagnés. Ce flux d'électrons entre l'anode et la cathode constitue le courant électrique, source d'énergie pour nos appareils électroniques.
L'histoire de la cathode et de l'anode est intimement liée à la découverte de l'électricité. Dès le 18ème siècle, les expériences de Galvani et Volta ont mis en évidence le rôle des métaux dans la génération de courant. Ces premières observations ont pavé la voie à l'invention de la pile voltaïque, premier générateur de courant continu, et à une meilleure compréhension des réactions électrochimiques impliquant une électrode positive et une électrode négative.
L'importance de ces deux pôles électriques est considérable. Des batteries qui alimentent nos smartphones aux procédés industriels d'électrolyse, en passant par les piles à combustible et les panneaux solaires, la cathode et l'anode sont omniprésentes. Comprendre leur fonctionnement est crucial pour développer des technologies plus performantes et plus durables.
Malgré leurs nombreux avantages, l’utilisation de la cathode et de l’anode soulève certains défis. La corrosion, la durée de vie limitée des batteries, et l’impact environnemental de certains matériaux utilisés pour fabriquer les électrodes sont autant de problèmes que les chercheurs s’efforcent de résoudre. L'optimisation des matériaux et la recherche de nouvelles compositions chimiques sont au cœur des innovations dans ce domaine.
Un exemple simple pour illustrer le fonctionnement de la cathode et de l'anode est la pile classique. Le zinc de la pile s'oxyde à l'anode, libérant des électrons qui circulent dans le circuit externe jusqu'à la cathode, où le dioxyde de manganèse est réduit. Ce flux d'électrons alimente l'appareil connecté à la pile.
Trois avantages majeurs ressortent de l'utilisation de la cathode et de l'anode : la production d'énergie électrique (batteries, piles à combustible), la réalisation de réactions chimiques spécifiques (électrolyse, galvanoplastie) et le stockage de l'énergie (batteries rechargeables). Ces applications sont essentielles pour notre société moderne.
Avantages et Inconvénients de la Cathode et de l'Anode
FAQ :
1. Quelle est la différence entre une cathode et une anode ?
L'anode est l'électrode où a lieu l'oxydation, tandis que la cathode est l'électrode où a lieu la réduction.
2. Comment identifier la cathode et l'anode dans une pile ?
Dans une pile, l'anode est le pôle négatif et la cathode le pôle positif.
3. Quel est le rôle de l'électrolyte ?
L'électrolyte permet la migration des ions entre l'anode et la cathode, assurant le passage du courant.
4. Quels matériaux sont utilisés pour fabriquer les cathodes et les anodes ?
Divers matériaux sont utilisés, comme le zinc, le carbone, le lithium, le dioxyde de manganèse, etc., en fonction de l'application.
5. Qu'est-ce que la corrosion d'une électrode ?
La corrosion est la détérioration d'une électrode due à des réactions chimiques avec son environnement.
6. Comment améliorer la durée de vie d'une batterie ?
L'utilisation de matériaux plus résistants à la corrosion et l'optimisation des réactions électrochimiques permettent d'améliorer la durée de vie d'une batterie.
7. Quelles sont les applications de l'électrolyse ?
L'électrolyse est utilisée pour produire de l'aluminium, du chlore, de l'hydrogène, etc.
8. Quel est l'avenir des technologies basées sur la cathode et l'anode ?
La recherche se concentre sur le développement de matériaux plus performants, plus durables et plus respectueux de l'environnement.
En conclusion, la cathode et l'anode sont des éléments fondamentaux de l'électrochimie. Leur compréhension est essentielle pour appréhender le fonctionnement de nombreux dispositifs et procédés qui nous entourent. Des batteries aux piles à combustible, en passant par l'électrolyse, ces deux pôles électriques jouent un rôle crucial dans notre quotidien et offrent un potentiel immense pour l'avenir des technologies. L'innovation continue dans ce domaine promet des avancées significatives en termes de performance, de durabilité et d'impact environnemental. En explorant de nouveaux matériaux et en optimisant les processus électrochimiques, nous ouvrons la voie à un futur plus électrifiant.
Lage de cyborg dans teen titans go mystere devoile
Informations et demarches administratives mairie de vic en bigorre
Voyage onirique genshin impact et linspiration des mille et une nuits
Électrolyse De La Solution De Sulfate De Cuivre à Lanode De Cuivre - Khao Tick On
Électrolyse définition et explications - Khao Tick On
la cathode et l'anode - Khao Tick On
la cathode et l'anode - Khao Tick On
Différence entre Anode et Cathode - Khao Tick On
Cathode Charge In Electrolysis - Khao Tick On
Battery Diagram Anode Cathode - Khao Tick On
Cathode Electrolyte Circuit Diagram - Khao Tick On
What Forms At The Cathode During Electrolysis - Khao Tick On
Electrode Terminal Definition at Tiffany Walls blog - Khao Tick On
Labelled Diagram Of Electrolysis - Khao Tick On
Anode and cathode scientific physics education diagram vector - Khao Tick On
Anode cathode positive ou négative dans la cellule électrolytique - Khao Tick On
Électrode définition et explications - Khao Tick On
la cathode et l'anode - Khao Tick On